細菌および宿主遺伝子発現に着目した新たな創傷感染症コントロール手法の開発
従来から、創傷感染は細菌の量的有意性が原因と考えられ、主に細菌数の定量によって診断を行われてきましたが、褥瘡のような開放性創傷の場合、常に細菌に汚染されていることが多く、細菌培養検査の診断意義は非常に低いと言われています。そこで、発赤や腫脹などの炎症徴候の主観的評価による感染診断が行われることになりますが、高齢者ではその炎症徴候すら出ない場合があります。そのため、感染診断を適切に行うことができず、治療が遅れ、入院期間の延長や合併症の発生などが起こることが問題となっております。これらの問題点を解決するため、私たちは細菌および宿主の遺伝子発現を解析することで、褥瘡が感染しているかどうかをアセスメントする技術の開発を目指しています。また、この技術を応用し、抗生物質に依らない感染制御法の開発も行っております。現在、各種動物モデルを用いて検討を進めているところです。今後、褥瘡滲出液を用いて、ベッドサイドで感染の診断ができるようになることが目標です。
具体的な研究テーマ
- 褥瘡感染における緑膿菌クオラムセンシングシステムの役割の解明
褥瘡感染における緑膿菌クオラムセンシングシステムの役割の解明
背景
褥瘡は開放性の創傷ですので、周囲皮膚や排泄物からの細菌暴露を受けています。つまり、消毒を行ってもすぐに細菌が増えるので細菌感染は防げません。感染症は宿主の免疫力と細菌の病原性のバランスが崩れることによって生じるため、創傷治癒を促進させながら、かつ細菌の病原性を減弱させるような新規アプローチが感染制御には必要となります。
そこで、私たちは細菌の病原性の発現システムである「クオラムセンシング」というシステムに着目し、病原性を減弱させるための方法を模索しています。
クオラムセンシングとは?
クオラムセンシングを、当研究室で使用している緑膿菌を例にとって説明してみましょう。
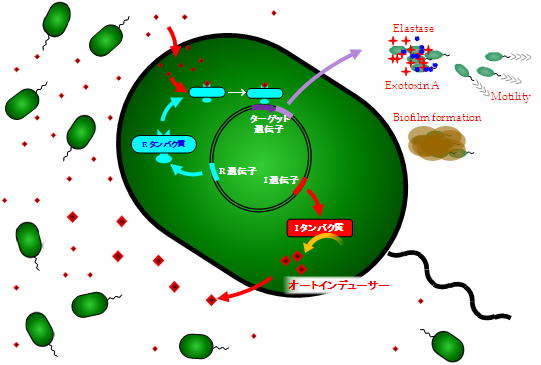
クオラムセンシングとは「仲間が少ない時には、宿主の免疫に見つけられないように潜んでおいて、仲間が増えたら一気に病原因子を発現して、宿主に対して優位に立とうとする戦法」です。これをもう少し科学的に説明すると、「オートインデューサー(AI)を介して細菌同士が互いにコミュニケーションをとり、AIが一定の濃度を越えると特定の遺伝子発現を活性化させる(あるいは抑制する)システム」です。つまり、細菌同士の会話の手段としてAIという小さな分子が使われ、その濃度を正確にセンシングし、一定の濃度(=仲間の集まり具合)を越えたときに病原性を発揮するシステムといえます。
私たちの研究室では、緑膿菌をモデルに、各種遺伝子改変株を使用して、褥瘡感染におけるクオラムセンシングの役割を検討してきました。緑膿菌はグラム陰性桿菌ですが、このグラム陰性菌は、大きくI遺伝子とR遺伝子と呼ばれるものを持っています。緑膿菌のI遺伝子(lasI, rhlI)からAI合成酵素が、R遺伝子(lasR, rhlR)からR蛋白質が合成されます。緑膿菌によって産生されたAIが菌体外へ排出され、それらの環境濃度が一定のレベルを超えると、菌体内に産生されたR蛋白質と結合し、AI-蛋白質複合体が特定の遺伝子のプロモーター領域に結合することで遺伝子発現を上昇させます。緑膿菌の場合はそれらの遺伝子に、エラスターゼやエキソトキシン、バイオフィルムなど、病原性に関わる因子が含まれているため、クオラムセンシングが感染成立に重要な役割を果たしていることが多くの研究で示されています。
しかし、褥瘡感染において、クオラムセンシングがどのように関わっているのかは全く調べられていませんでした。特に、褥瘡は肺炎や腎盂腎炎などの感染症と異なり、外界と解放されており、かつ虚血状態であるという特殊性があるため、本当にクオラムセンシングが褥瘡部位で発動されるかどうかは分かりません。そこで、私たちは褥瘡動物モデルを使ってクオラムセンシングの関与を調べました。
もし、クオラムセンシングが関与していることになれば、クオラムセンシングを阻害する方法によって感染症を予防できる可能性があります。この新規アプローチは世界中で研究がすすめられている分野です。その理由は、このアプローチは薬剤耐性菌を生み出さないという利点があるからです。ご存知の通り、現在、薬が利かない細菌(薬剤耐性菌)の問題が非常に大きくなっております。細菌が抗生物質にさらされると、突然変異を起こして抗生物質耐性を有する変異株が現れます。重要なのは、そのまま抗生物質を使うと、その変異株のみが生き残る(セレクション)ため、耐性菌が優位になってしまうという点です。そうなってしまうと、薬が効きませんから、治療方法がなくなってしまいます。つまり、細菌を殺そうとする治療法は必ず耐性菌を生み出す危険性があるということです。一方、クオラムセンシングを阻害すると、細菌は病原性を発揮することはできませんが、クオラムセンシングは細胞分裂に関わりませんので、細菌が死滅することはありません。したがって、耐性菌ができる心配がほとんどないのです。この点が、クオラムセンシング阻害の最も優れた利点です。
私たちはこのような、細菌と宿主のバランスの調和を目指した、新しい看護技術の開発を目指して研究を行っております。
アプローチ
褥瘡感染に緑膿菌のクオラムセンシングが関与しているかどうかを調べるために、ラット褥瘡モデルを作成し、そこに緑膿菌を接種し、その反応を検討しました。ある系が関連しているかどうかを調べる方法として、その系が欠損している状態だとどうなるかというのをみることが有用なアプローチとして考えられています。この研究でも、クオラムセンシング欠損株(I遺伝子欠損株、R遺伝子欠損株)を準備して、それを褥瘡に接種するとどうなるかを、野生株と比較して検討しました。
利用する技術
- 動物実験(学内のP2A施設を利用して行います)
- 細菌培養装置(無菌操作などができるシステム)
- 病理学的検査
- 走査電子顕微鏡(バイオフィルムを観察します)
結果の概要
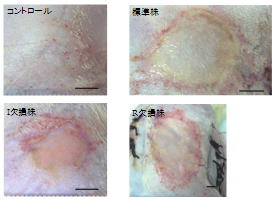
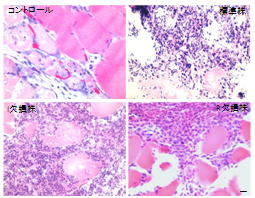
興味深いことに、褥瘡感染モデルでは、I欠損、R欠損緑膿菌を接種しても、標準株と同様に強い炎症の誘導と組織の損傷を引き起こしました。これは他の感染モデルでは見られなかった現象です。

しかし、褥瘡部の組織を採取し、大きく拡大して観察すると、クオラムセンシングが動くことで生じるバイオフィルムの成熟化が、標準株でのみ観察されました。
これらの結果を総合して考えてみます。緑膿菌はクオラムセンシングを欠損していても宿主の急性炎症を引き起こすことによって、組織障害を引き起こします。これはおそらく、緑膿菌が宿主によって認識され、自然免疫が発動することによって生じる急性炎症による組織障害であると思われます。一方、緑膿菌の形態を観察すると、バイオフィルムという多糖類に囲まれた中で生活していることが分かります。バイオフィルムは組織の免疫反応や薬剤に対する耐性が強いため、一度形成されると排除することは容易ではありません。したがって、クオラムセンシングが働くことで、緑膿菌は宿主に長く寄生することができ、それが慢性感染につながっているのではないかということが予測されます。
バイオフィルムに関連した褥瘡感染に緑膿菌のクオラムセンシングシステムが関与していることが分かりました。これらから、クオラムセンシング阻害を行うことで褥瘡の感染を予防できる可能性が示され、現在その新規アプローチ方法について研究を行っているところです。
論文
- Nakagami G, Morohoshi T, Ikeda T, Ohta Y, Sagara H, Huang L, Nagase T, Sugama J, Sanada H. Contribution of quorum sensing to the virulence of Pseudomonas aeruginosa in pressure ulcer infection in rats. Wound Repair Regen. 2011;19(2):214-22
- Nakagami G, Sanada H, Sugama J, Morohoshi T, Ikeda T, Ohta Y. Detection of Pseudomonas aeruginosa quorum sensing signals in an infected ischemic wound: An experimental study in rats. Wound Repair Regen. 2008;16(1):30-6.
- 仲上豪二朗, 真田弘美, 須釜淳子, 諸星知広, 池田宰. 感染虚血性創傷における細菌数とクオラムセンシングシグナルの関係. 日本褥瘡学会誌. 2007;9(2):165-70.

